Coleta de amostras
PROCEDIMENTOS DE FIXAÇÃO DE AMOSTRAS PARA
RT-PCR, qPCR e qRT-PCR
1. Objetivo
Objetivo consiste em realizar uma análise geral ou especifica seguindo uma metodologia adequada e sistemática e que estará focada nos seguintes procedimentos: o conhecimento do histórico clínico; a amostragem; exame por meio de biópsia e necrópsia; e molecular.
2. Finalidade
Aplica-se aos colaboradores da área de Diagnóstico de enfermidades de Crustáceo – LAQUA para o procedimento de coleta de amostras para o posterior diagnóstico.
3. Descrição e definições
O estudo biopatológico executa tarefas e análise especializada por meio de método qualitativo ou quantitativo de amplificação de ácidos nucleicos (PCR, qPCR etc.) e por fim a confecção do relatório. Em resumo, consiste em realizar uma análise geral ou especifica seguindo uma metodologia adequada e sistemática e que estará focada nos seguintes procedimentos: o conhecimento do histórico clínico; a amostragem; exame por meio de biópsia e necrópsia; e avaliação histopatológica e/ou molecular.
4. Procedimentos
a) O conhecimento do histórico clínico; enviar todos os dados referentes ao histórico do problema assim como o nome da fazenda, viveiro, data de coleta, parâmetros físico-químicos, biometria, periodicidade de arraçoamento (se feito) Comportamento (hiperatividade, natação errática), prevalência das lesões em uma escala de 100%.
b) A amostragem; selecionar indivíduos que apresentarem os mesmos sinais de doença a ser estudada (nos escolheremos os melhores indivíduos para análise). Considerar que todos os procedimentos deverão ser feitos de maneira rápida para evitar mascaramento nas lesões por formação de artefatos, hipoxia e autólise dos tecidos.
5. Segurança
Utilizar luvas e cuidado ao manusear o animal.
6. Materiais utilizados
- Luvas
- Pinça esterilizada
- Tubos de armazenamento
- Lápis
- Papel vegetal
6.1 Meios e soluções
- Álcool etílico 95%
- cloro ativo 200 ppm
7. Coleta das Amostras
Capturar camarões moribundos que apresentam sintomas da doença.
8. Fixação e Preservação
Pós-larvas e brânquias, hepatopâncreas, pleópodos, hemolínfa e outras amostras:
– Confeccionar histórico e fotografar.
– Coletar aproximadamente 0.5 g ou ml dos indivíduos (ver anexo 1).
– Colocar em recipientes novos ou bem limpos com a solução de álcool etílico 95%.
– Colocar os indivíduos dentro dos recipientes contendo a solução de álcool etílico 95%(deixar amostras bem cobertas com álcool).
– Etiquetar usando lápis e papel vegetal e/ou caneta permanente.
– Lacrar bem as tampas.
– Fechar e lavar externamente com 200 ppm de cloro ativo retirando em seguida o teor residual com água potável.
– Preparar e enviar
OBS: A elaboração de um histórico e foto promove relevante informação clinica na submissão de amostras, facilitando assim a interpretação dos resultados em relação ao agente causador da enfermidade nos camarões submetidos.
9. Descarte de Resíduos
Os materiais utilizados deverão ser armazenados para posterior esterilização.
10. Bibliografia
OIE (WORLD ORGANISATION FOR ANIMAL HEALTH) (2017).
11. Anexos
ANEXO 1: REGIME DE AMOSTRAGEM PARA DIAGNÓSTICO DE INDIVIDUOS MORIMBUNDOS SELECIONADOS PARA AVALIAÇÃO
Para análise de PCR (atentar para a idade do camarão):
| Se Idade | Órgão/tecido# | Fixador | No. camarões
/Lote |
| PL5-35 (0.001 a 0.5gr) | PL inteira | Álcool 95% | 30-10 (PCR) |
| PL35-70
(0.5 – 6gr) |
Cefalotórax | Álcool 95% | 10-5 (PCR) |
| 6-30 gr | Pleópodos/brânquias hepatopâncreas | Álcool 95% | 5 (PCR) |
| 30-60 gr | Pleópodos//brânquias
hepatopâncreas |
Álcool 95% | 5 (PCR) |
# Pleópodos ou brânquias (IMNV,WSSV, IHHNV, TSV, YHV, CMNV).
# Hepatopâncreas (AHPND “EMS”, NHP-B, HPV,BP,EHP).
ANEXO 2: COLETA E FIXAÇÃO DE AMOSTRAS PARA DIAGNOSTICO
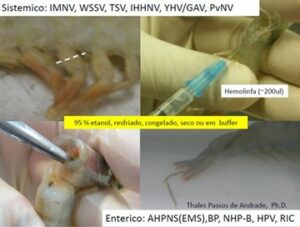
Figura 1. Formas de coleta de amostra

Figura 2. Procedimentos para embalagem de amostragens de pleopodos, pós-larvas, branquias, hepatopancreas, hemolinfa e outras pequenas amostras; 1) colocar alcool 95% nos tubos; 2) Colocar a amostra; 3 e 4 ) Completar com alcool, lacrar e identificar; 5) Colocar todas as amostras em um saco maior, vedar bem e em seguida colocar o pacote protegido dentro de uma caixa de isopor e remeter.
PROCEDIMENTOS DE FIXAÇÃO DE AMOSTRAS PARA HISTOLOGIA
1. Objetivo
Objetivo consiste em realizar uma análise geral ou especifica seguindo uma metodologia adequada e sistemática e que estará focada nos seguintes procedimentos: o conhecimento do histórico clínico; a amostragem; exame por meio de biópsia e necrópsia; e avaliação histopatológica e/ou molecular.
2. Finalidade
Aplica-se aos colaboradores da área de Diagnóstico de enfermidades de Crustáceo – LAQUA para o procedimento de coleta e fixação de amostras para o posterior diagnóstico.
3. Descrição e definições
O estudo biopatológico executa tarefas e análise especializada por meio de processamento histológico, análise anatomo-biopatológica, histopatológica e/ou método qualitativo ou quantitativo de amplificação de ácidos nucleicos (PCR, qPCR etc.) e por fim a confecção do relatório. Em resumo, consiste em realizar uma análise geral ou especifica seguindo uma metodologia adequada e sistemática e que estará focada nos seguintes procedimentos: o conhecimento do histórico clínico; a amostragem; exame por meio de biópsia e necrópsia; e avaliação histopatológica e/ou molecular.
4. Procedimentos
a) o conhecimento do histórico clínico; enviar todos os dados referentes ao histórico do problema assim como o nome da fazenda, viveiro, data de coleta, parâmetros físico-químicos, biometria, periodicidade de arraçoamento (se feito) etc. Comportamento (hiperatividade, natação errática), prevalência das lesões em uma escala de 100%.
b) a amostragem; selecionar indivíduos que apresentarem os mesmos sinais de doença a ser estudada. Considerar que todos os procedimentos deverão ser feitos de maneira rápida para evitar mascaramento nas lesões por formação de artefatos, hipoxia e autólise dos tecidos.
5. Segurança
Utilizar luvas, óculos e máscara (para químicos) a fim de evitar contato com a solução fixadora.
6. Materiais utilizados
- Óculos de proteção
- Máscara de proteção
- Luvas
- Tesoura esterilizada
- Tubos de armazenamento
- Seringa com agulha
- Lápis
- Papel Manteiga
6.1 Meios e soluções
- Álcool etílico 70%
- Álcool etílico 95%
- Formalina 100%
- Ácido acético glacial
- Água destilada
Preparo da solução de DavidsonAFA (ver vídeo): Para o preparo de 1 litro da solução fixadora de Davidson deverão ser colocados 330 ml de álcool etílico 95%, 220 ml de formalina 100% (solução saturada de gás de formalina 36% a 39%); 115 ml de ácido acético glacial e 335 ml de água destilada.
7. Coleta das Amostras
Capturar camarões moribundos que apresentam sintomas da doença.
8. Fixação e Preservação (ver vídeo)
– Anotar o peso médio, viveiro, data e nome da empresa para identificar amostra.
– Utilizar luvas, óculos e máscara (para químicos) a fim de evitar contato com a solução fixadora.
– Injetar o mesmo volume (proporcional ao tamanho do camarão) da solução de Davidson utilizando uma seringa nas seguintes regiões do camarão:
Obs: Fixar bem todas as regiões evitando girar a agulha fora do seu eixo (não destruir os tecidos). Após a fixação, todas as partes do camarão estarão com uma coloração alaranjada. Realizar, com tesoura de incisão ou bisturi, um corte lateral na carapaça para melhor infiltração da solução de Davidson’s (e).
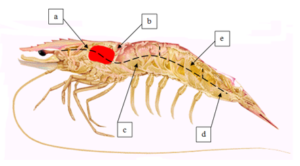
Figura 1- Lateral esquerda do hepatopâncreas (a) – Lateral esquerda do hepatopâncreas (b)- Lateral direita do hepatopâncreas (c)- Lateral e Anterior abdominal (1º segmento) (d)- Lateral e Posterior abdominal (6º segmento)
– Colocar os camarões em frascos (identificar viveiro) contendo a solução fixadora por um período apropriado para fixação.
– Para obter sucesso na fixação, considerar o tempo apropriado de fixação com Davidson:
- 12 horas para Pós-larvas;
- 24 horas para juvenis e pequenos adultos;
- 48 horas para reprodutores.
– Após o tempo de fixação com Davidson, transferir os camarões para frasco contendo álcool 70%.
– Após outras 24 horas, transferir os camarões para um novo álcool 70%.
*Iniciar embalagem para remessa ao laboratório de diagnostico.
9. Transporte das amostras para posterior análise.
As amostras podem ser transportadas em papel toalha, colocadas em sacos duplos os quais devem estar com todo interior encharcado com álcool 70%.
10. Processamento da embalagem (ver anexo)
– Remover os camarões do álcool 70%.
– Não retirar o excesso de álcool e envolver os camarões em papel toalha. (deixar bastante umedecido com a solução de álcool).
– Colocar uma ficha com a identificação da amostra (viveiro, peso…) e o camarão dentro de um saco plástico bem vedado (VEDAR BEM PARA EVITAR QUE O ÁLCOOL SE EXALE).
– Colocar o pacote dentro de um segundo saco (em sentido contrario) a fim de evitar vazamento de álcool.
– Redigir um histórico detalhado do problema (se possível com foto).
– Colocar as amostras dentro de uma embalagem protegida evitando o amassamento e ruptura dos tecidos dos camarões no processo de transporte (ex: isopor).
11. Descarte de Resíduos
As seringas e agulhas deverão ser descartados da maneira correta para posterior incineração.
12. Bibliografia
OIE (WORLD ORGANISATION FOR ANIMAL HEALTH) (2022). www.oie.int.
13. Anexos
ANEXO 1: PROCEDIMENTO PARA EMBALAGEM DE AMOSTRAS DE CAMARÃO FIXADOS

Figura 1. Procedimentos para embalagem de amostragens de camarões objetivando a chegada intacta das amostras de camarão inteiro no laboratorio de diagnóstico e em menor volume. 1) Após a fixação em Davidson, retirar o camarão do álcool 70%; 2) Colocar os camarões enfileirados em cima de papel toalha; 3), 4) e 5) Dobrar e colocar o pacote sobre um outro papel toalha; 6) e 7) Dobrar e colocar dentro de um saco tipo ziplock; 8), 9) e 10) Umedecer bem com álcool); 11) e 12) Colocar o pacote dentro de um segundo saco tipo ziploc posicionando a abertura para o fundo do segundo saco, evitando a evaporação de álcool; 13) e 14) Confeccionar etiqueta utilizando papel grosso e lápis (colocar a etiqueta dentro do segundo saco; 16) Colocar quantos pacotes de amostras forem necessários em um saco grande tipo ziploc (bem vedado) para o envio. Finalmente, colocar o pacote protegido dentro de uma caixa de isopor.
Preparação da solução de Davidson AFA para Histologia
Fixação com solução de Davidson para Histologia